Аннотация
Радиочастотная абляция (РЧА) является эффективным и малоинвазивным методом радикального лечения пароксизмальных тахикардии. В редких случаях после проведения РЧА возможно развитие такого осложнения, как инфаркт миокарда (ИМ).
Цель исследования. Представить клинический случай развития ИМ после процедуры РЧА у пациента с синдромом Вольфа-Паркинсона-Уайта.
Методы исследования. Мужчина 32 лет поступил в плановом порядке из-за частых приступов сердцебиения. Во время электрофизиологического исследования у него был установлен добавочный путь правой нижней парасептальной локализации. Пациенту проведена РЧА. После процедуры у него развилась ангинозная боль с элевацией сегмента ST и повышением уровня тропонина. Коронарография выявила стеноз 60-65% в дистальной трети правой коронарной артерии (КА), остальные КА без обструктивных поражений. Через 7 дней пациент был выписан в удовлетворительном состоянии.
Мы провели поиск публикаций в базах Pubmed, Google Scholar, Web of Science, Scopus, РИНЦ с ключевыми словами «синдром WPW», «радиочастотная абляция», «инфаркт миокарда».
Результаты. Частота случаев развития ИМ при РЧА находится в диапазоне 0,06-0,1%. Эксперты предполагают следующие механизмы развития данного осложнения: коронарный спазм, термическое повреждение эндотелия КА, что ведет к развитию острого и подострого тромбоза. Риск повреждения КА возрастает при длительном воздействии высокой энергии и проведении РЧА вблизи коронарного синуса, особую осторожность следует соблюдать, если расстояние от КА до зоны абляции составляет менее 2 мм, в такой ситуации вероятность повреждения КА увеличивается до 50%.
Выводы. Вероятность развития ИМ после РЧА повышается при вмешательствах в области коронарного синуса. Увеличение риска связано с расстоянием от КА до зоны абляции, мощностью и длительностью воздействия радиочастотной энергии, дополнительное влияние оказывают «эффект конвективного охлаждения», «эффект тени» и повторные процедуры РЧА.
Ключевые слова: радиочастотная абляция, синдром Вольфа-Паркинсона-Уайта, инфаркт миокарда
Введение. Радиочастотная абляция (РЧА) является эффективной процедурой для лечения пациентов с приступами сердцебиения. В соответствии с действующими рекомендациями по диагностике и лечению суправентрикулярных тахикардии, РЧА имеет I класс показании для лечения атриовентрикулярной реципрокной тахикардии (АВРТ) [1, 2]. Процедура выполняется во всех электрофизиологических лабораториях и характеризуется низкой частотой осложнении, благодаря минимальному повреждению миокарда [3, 4].
Успех РЧА при синдроме Wolf-Parkinson-White (WPW) достигает 95% и зависит от локализации и количества дополнительных путей проведения, а также опыта оператора [5, 6]. Несмотря на высокую эффективность и безопасность процедуры РЧА, следует учитывать возможность редкого, но серьёзного осложнения, как инфаркт миокарда (ИМ). По данным ретроспективных исследований, его частота составляет от 0,06 до 0,1%, с более высоким риском у пациентов с ранее существовавшими сердечно-сосудистыми заболеваниями [7]. Развитие ИМ требует немедленного вмешательства, так как может ухудшить исходы лечения.
Большинство пациентов с синдромом WPW – это молодые мужчины без сопутствующих заболеваний. В виду их активного образа жизни, развитие ИМ после РЧА может существенно повлиять на качество жизни, трудоспособность и долгосрочный прогноз [8].
Важно обеспечить профилактику этого осложнения, включая подбор пациентов, планирование процедуры, а после РЧА тщательное наблюдение с целью своевременной диагностики и лечения.
Цель исследования. Представить редкий клинический случай развития ИМ после процедуры РЧА у пациента с синдромом Вольфа-Паркинсона-Уайта.
Материалы и методы. Пациент, 32-летний мужчина, был госпитализирован в кардиологическое отделение в плановом порядке для проведения ЭФИ и РЧА дополнительного атриовентрикулярного (АВ) соединения. Он жалуется на приступы внезапного сильного сердцебиения на протяжении 2-х лет. Вне приступов сердцебиения пациент чувствует себя хорошо, работает пожарным. Пациент прошел амбулаторное обследование, другой патологии у него не выявлено. На ЭКГ при поступлении: синусовый ритм 80 уд/мин, классические признаки предвозбуждения желудочков. В архиве ЭКГ имеется пленка с пароксизмом ортодромной АВРТ с частотой 186 уд/мин.
Протокол операции. Пациент доставлен в рентгеноперационную на синусовом ритме с RR- 700 мсек, PQ 95 мсек, QRS 125 мсек. После местной анестезии под контролем УЗИ произведена пункция и катетеризация правой бедренной вены по методу Сельдингера, установлен интродьюсер 6Fr, через него проведен 10 полюсный неуправляемый электрод EasyFinder 10, 2-8-2 в позицию коронарного синуса (КС), данных за преэкзитацию левой локализации не выявлено. При проведении антеградной программируемой стимуляции из КС 5-6: точка Венкебаха (ТВ) составляет 380 мсек, эффективный рефрактерный период (ЭРП) атриовентрикулярного узла – 600-320 мсек, провоцируется ортодромная тахикардия с длительностью цикла 330 мсек. Под местной анестезией по методу Сельдингера, произведена пункция правой бедренной вены, введен управляемый интродьюсер PathFinder 8,5 Fr, через который проведен абляционный орошаемый катетер FireMagic 2-5-2, подсоединен к трубке Optialate 2 мл-30 мл. Проведено картирование АВ борозды правого предсердия, выявлена зона ранней активации правой нижней парасептальной локализации. В данной зоне произведена абляция с параметрами 45Вт, температура 45С, 118 Ом, 60 сек, орошением 2-30 мл. По данным внутрисердечной электрограммы отмечался «Эффект» (рис.1).
Проведено контрольное ЭФИ: PQ 130 мсек., QRS 110 мсек., антеградная ТВ 400 мсек, антеградный ЭРП 600-330 мсек, тахикардия не провоцируется. При ретроградной стимуляции В-А проведение декрементное, ретроградная ТВ 310 мсек., ЭРП 600-330 мсек. Данных за ДПЖС не выявлено.
После завершения процедуры РЧА на мониторе наблюдалась элевация сегмента ST. Пациенту выполнена 12 канальная ЭКГ, ритм синусовый с подъёмом сегмента ST в отведениях III, II и AVF без захвата правого желудочка (рис.2).
Изменения на ЭКГ сопровождались умеренной болью за грудиной с иррадиацией в левую руку, пациент переведен в блок интенсивной терапии. По данным эхокардиографии: камеры сердца не увеличены, фракция выброса 55%, расчетное систолическое давление в легочной артерии 28 мм.рт.ст. Учитывая клинику и подъем сегмента ST на ЭКГ пациент подан в ангиографическую лабораторию. КАГ показала стеноз 60-65 % в дистальной трети правой КА, остальные сосуды без обструктивных поражений, реваскуляризация не проводилась (рис.3).
Уровень тропонина на следующий день увеличился до 10 нг/мл, тогда как после процедуры был 0,31 нг/мл. Пациент получал лечение: таб. Clopidogrel 75 мг/сут, таб. Aspirin 100 мг/сут, р-р Fondaparinux 2,5 мг/сут, таб. Bisoprolol 2,5 мг/сут, таб. Omeprazole 40 мг/сут. На фоне проведенной терапии состояние пациента удовлетворительное, боли, одышки в покое и при физической нагрузке не отмечалось. АД 110/70 мм.рт.ст. Пульс- 62 уд. в минуту. На ЭКГ при выписке: Синусовый ритм с ЧСС 75 уд/мин, подострый период ИМ нижней стенки левого желудочка с зубцом Q, (рис.4). Он выписан в удовлетворительном состоянии под наблюдение кардиолога по месту жительства.
Мы провели поиск публикаций в базах Pubmed, Google Scholar, Web of Science, Scopus и РИНЦ с ключевыми словами «синдром WPW», «радиочастотная абляция», «инфаркт миокарда».
У пациента Д. мы получили согласие на публикацию клинического случая в медицинском журнале.
Результаты и обсуждение. Наш пациент обратился с жалобами на приступы сердцебиения. Во время электрофизиологического исследования у него верифицирована ортодромная АВРТ с зоной ранней активации правой нижней парасептальной локализации, в этой зоне выполнена РЧА. В раннем периоде после РЧА зафиксирован подъем сегмента ST в нижних отведениях без захвата правого желудочка. Изменения на ЭКГ сопровождались типичной ангинозной болью и повышением уровня тропонина. Пациенту выполнена КАГ, которая выявила стеноз 60-65% в дистальной трети правой КА, рекомендовано консервативное лечение. На 7-сутки пациент выписан из стационара в удовлетворительном состоянии.
Удаление нижних парасептальных дополнительных путей, как в случае нашего пациента, требует вмешательства в зоне коронарного синуса, где близко располагаются ветви правой КА. Риск повреждения КА при РЧА в этой зоне зависит от расстояния между КА и местом абляции [9, 10]. Stavrakis S. и коллеги выполнили РЧА у 240 пациентов с эпикардиальными заднесептальными добавочными путями. Средний возраст пациентов составил 31,7±15,5 лет, расстояние между идеальным местом абляции и ближайшим значимым коронарным сосудом с диаметром более 1 мм составило Me 2 (1-5) мм. У 100 (59%) пациентов расстояние от идеального места абляции до значимой КА составило менее 2 мм, у 28 (16%) пациентов это расстояние составило от 3 до 5 мм, у 41 (25%) пациентов более 5 мм. После РЧА на расстоянии менее 2 мм у 11 (50% [95%ДИ:28-72%]) пациентов развился стеноз КА, варьирующий от 25% до более 50%, включая полную окклюзию у 3 пациентов. После абляции на расстоянии 3-5 мм только у 1 пациента (7% [95% ДИ 0%-32%]) был обнаружен 70% стеноз КА. После РЧА на расстоянии более 5 мм не было ни одного случая повреждения КА. Авторы исследования сделали вывод, что радиочастотная энергия, доставляемая в пределах 2 мм от КA, связана с высоким (50%) риском повреждения КA. Они считают, что криоабляция является безопасной и достаточно эффективной альтернативой, когда значимая КА расположена близко к идеальному месту абляции. Исследователи подчеркивают важность проведения КАГ для обсуждения стратегии абляции при наличии субстрата аритмии в области коронарной венозной системы [11].
Радиочастотная энергия вызывает спазм КА, прямую термическую травму сосуда, повреждение эндотелия. Повреждение эндотелия снижает способность сосудов регулировать сосудистый тонус и свертываемость, повышая вероятность развития острого и подострого тромбоза [12]. Спазм считается редким, но опасным осложнением, которое может возникнуть в любое время в течение перипроцедурального периода [13]. В более отдаленном периоде развитие фиброза и ремоделирования сосудистой стенки может привести к стенозу КА и хронической ишемии миокарда [14]. Таким образом, пациенты, которые перенесли процедуру РЧА, требует длительного мониторинга за своим состоянием.
Понимание взаимосвязи факторов, приводящих к повреждению КА, и состояния коронарного кровотока имеет важное значение для безопасной и эффективной РЧА. Конвективный эффект охлаждения от коронарного кровотока достигается за счет притока крови, что создает "теплоотвод" и предотвращает значительное нагревание эндотелия сосудов. Кровоток через коронарные сосуды предотвращает нагревание и повреждение окружающих тканей, что создает уже эффект «тени» для окружающих тканей и предотвращает развитие нарушений проводимости после РЧА. Эффект конвективного охлаждения и эффект «тени» могут быть утрачены у молодых пациентов с небольшим сердцем и диаметром сосуда менее 3 мм, что может привести к более высокому риску термического повреждения. Более высокому риску термической травмы подвержены КА, суженные из-за атеросклеротического процесса, у лиц с ишемической болезнью сердца [15, 16].
Ориентация абляционного катетера, также является фактором, который определяет риск развития повреждения КА. Подача радиочастотной энергии электродом, ориентированным перпендикулярно КА (когда электрод в вене сдавливает артерию) сопряжена с более высоким риском повреждения КА по сравнению с электродом, ориентированным параллельно артерии [11, 15, 17].
Для планирования безопасной и эффективной РЧА важно понимание того, как прогрессируют патологические изменения в тканях после РЧА. Изменения в месте поражения наблюдаются сразу же после радиочастотной терапии и длятся до 8 недель. Радиочастотная терапия приводит к мгновенному изменению цвета тканей из-за денатурации белков, в основном миоглобина, который теряет свой красный пигмент. Через несколько часов после РЧА гистологическое исследование выявляет центральную зону коагуляционного некроза, которая окружена геморрагической переходной зоной (грануляционная ткань), в которой присутствуют мононуклеарные воспалительные клетки, что приводит к периваскулярному отеку и стенозу. Через 4-5 дней переходная зона исчезает, в центральной зоне обнаруживаются коагуляционный некроз и ранние жировые изменения. К концу первой недели отмечается жировое замещение, а к восьмой неделе зона коагуляционного некроза полностью замещается фиброзом [15].
Криоабляция имеет лучший профиль безопасности, когда значимая КА расположена рядом с идеальным местом абляции, что делает её методом выбора для таких ситуаций. По данным экспериментальных исследований при криоабляции не было признаков повреждения сосудов при проведении двойных и тройных циклов замораживания, но частота рецидивов была выше [18]. В условиях нашего МЦ процедура криоабляции находится на этапе внедрения.
Врачи должны всегда помнить о таком типе осложнений РЧА, как ИМ, даже у пациентов без сердечно-сосудистых заболеваний. Мониторинг ЭКГ в 12 отведениях важен во время и после процедуры. После РЧА часто наблюдаются изменения реполяризации в виде инверсии зубца Т, которые считаются нормальными и не указывают на патологию [19]. Изменения сегмента ST, как депрессия или подъем могут быть временными, но если эти эпизоды повторятся во время процедуры или сохранятся после неё, то необходимо срочно провести диагностическую катетеризацию сердца, чтобы исключить любую возможность повреждения КА [20].
Существует комплекс мер, которые снижают частоту повреждения КА и повышают эффективность РЧА. Рекомендуется свести к минимуму подачу радиочастотной энергии во время абляции, особенно у маленьких пациентов, у которых жизненно важные структуры располагаются близко к месту абляции, или у пациентов с тяжелым стенозом КА, подчеркивается необходимость рентгеноскопического подтверждения положения катетера, важно, чтобы перед процедурой РЧА операторы имели представление об анатомии КА относительно анатомических ориентиров [10].
У пациентов с известной или предполагаемой ИБС коронарография может оценить протяженность и определить анатомическую взаимосвязь между катетером и коронарными сосудами [21].
Ограничения исследования. Мы располагали только протоколом исследования и данными электрофизиологического исследования, без доступа к визуальному материалу процедуры ЭФИ и РЧА, мы не представили суммарное количество приложенной радиочастотной энергии. Указанные обстоятельства ограничивают возможность проанализировать индивидуальные причины развития ИМ у нашего пациента.
Заключение. Вероятность развития ИМ после РЧА составляет 0,06-0,1% и повышается при вмешательствах в области коронарного синуса. Увеличение риска связано с рядом факторов, как расстояние от КА до зоны абляции, мощность и длительность воздействия радиочастотной энергии, дополнительное влияние оказывают «эффект конвективного охлаждения», «эффект тени» и повторные процедуры. Перед РЧА в области коронарного синуса следует выполнять его ангиографию, при повторных процедурах компьютерную томографию КА. Улучшение операторской техники, использование новых технологий абляции, регулярный анализ ЭКГ, мониторинг маркеров повреждения миокарда и эхокардиографии в пери- и пост процедурном периодах имеют решающее значение для своевременного выявления и профилактике повреждения КА, связанных с проведением РЧА.
Авторы выражают благодарность Реквава Р.Р. – руководителю отделения аритмологии и сердечной электрофизиологии «Американского Госпиталя Тбилиси», Президенту «Общества сердечного ритма Шёлкового пути», г.Тбилиси, Грузия за полезную дискуссию на этапе планирования статьи.
Конфликт интересов. Авторы подтверждают отсутствие конфликта интересов и финансовой поддержки.
Авторство. Куанова Д.Е. – сбор, анализ, интерпретация данных, написание первого варианта статьи, окончательное утверждение статьи. Тлегенова Ж.Ш. – концепция статьи, анализ, дискуссия, редактирование, окончательное утверждение статьи.
Куанова Д.Е. – резидент по специальности «Кардиология взрослая, детская»
Тлегенова Ж.Ш. – PhD, доцент кафедры «Внутренние болезни №2»
Куанова Д.Е. - https://orcid.org/ 0009-0007-2804-3431
Тлегенова Ж.Ш. - http://orcid.org/ 0000-0002-3707-7365, SPIN 8403-4695
<
- Brugada J, Katritsis DG, Arbelo E, Arribas F, Bax JJ, Blomström-Lundqvist C, et al. 2019 ESC Guidelines for the management of patients with supraventricular tachycardia The Task Force for the management of patients with supraventricular tachycardia of the European Society of Cardiology (ESC). Eur Heart J. 2020 Feb 1;41(5):655-720. doi: 10.1093/eurheartj/ehz467.
- Клинические протоколы Министерства здравоохранения Республики Казахстан №66 от 16 мая 2019г. Синдром преждевременного возбуждения желудочков. Available from: https://diseases.medelement.com/disease/ Синдром преждевременного возбуждения желудочков > Клинические протоколы МЗ РК - 2018 (Казахстан) > MedElement.
- Haines DE, Beheiry S, Akar JG, Baker JL, Beinborn D, Beshai JF, et al. Heart Rythm Society expert consensus statement on electrophysiology laboratory standards: process, protocols, equipment, personnel, and safety. Heart Rhythm. 2014 Aug;11(8):e9-51.
doi: 10.1016/j.hrthm.2014.03.042.
- Перегудина О.Л., Чуева К.А., Татарский Р.Б., Лебедев Д.С., Васильева Е.Ю., Каюмова Е.Е., Васичкина Е.С. Маркеры повреждения и воспаления миокарда после радиочастотной аблации у детей и подростков. Российский кардиологический журнал. 2021;26(12):4756. https://doi.org/10.15829/1560-4071-2021-4756
- Dulai R, Bangash F, Sharma A, Cambridge A, Wong G, Lim W, et al. Open Window Mapping of Accessory Pathways: A Literature Review and Practical Guide. Arrhythm Electrophysiol Rev. 2023 Dec 1;12:e28. doi: 10.15420/aer.2023.09
- Eitel C, Ince H, Brachmann J, Kuck KH, Willems S, Spitzer SG, et al. Catheter ablation of supraventricular tachycardia in patients with and without structural heart disease: insights from the German ablation registry. Clin Res Cardiol. 2022 May;111(5):522-529.
doi: 10.1007/s00392-021-01878-z
- Roberts-Thomson KC, Steven D, Seiler J, Inada K, Koplan BA, Tedrow UB, et al. Coronary artery injury due to catheter ablation in adults: presentations and outcomes. Circulation. 2009 Oct 13;120(15):1465-73. doi: 10.1161/CIRCULATIONAHA.109.870790.
- Lu CW, Wu MH, Chen HC, Kao FY, Huang SK. Epidemiological profile of Wolff-Parkinson-White syndrome in a general population younger than 50 years of age in an era of radiofrequency catheter ablation. Int J Cardiol. 2014 Jul 1;174(3):530-4.
doi: 10.1016/j.ijcard.2014.04.134
- Garabelli PJ, Stavrakis S, Po SS. A case series and review of the literature regarding coronary artery complications associated with coronary sinus catheter ablation. HeartRhythm Case Rep. 2015 May 26;1(5):315-319. doi: 10.1016/j.hrcr.2015.04.008.
- Mao J, Moriarty JM, Mandapati R, Boyle NG, Shivkumar K, Vaseghi M. Catheter ablation of accessory pathways near the coronary sinus: value of defining coronary arterial anatomy. Heart Rhythm. 2015 Mar;12(3):508-514. doi: 10.1016/j.hrthm.2014.11.035
- Stavrakis S, Jackman WM, Nakagawa H, Sun Y, Xu Q, Beckman KJ, et al. Risk of coronary artery injury with radiofrequency ablation and cryoablation of epicardial posteroseptal accessory pathways within the coronary venous system. Circ Arrhythm Electrophysiol. 2014 Feb;7(1):113-9. doi: 10.1161/CIRCEP.113.000986
- Pieragnoli P, Gori AM, Ricciardi G, Carrassa G, Checchi L, Michelucci A, et al. Effects of cryoablation and radiofrequency ablation on endothelial and blood clotting activation. Intern Emerg Med. 2014 Dec;9(8):853-60. doi: 10.1007/s11739-014-1090-7.
- Nakamura T, Takami M, Fukuzawa K, Kiuchi K, Kono H, Kobori A, et al. Incidence and Characteristics of Coronary Artery Spasms Related to Atrial Fibrillation Ablation Procedures - Large-Scale Multicenter Analysis. Circ J. 2021 Feb 25;85(3):264-271.
doi: 10.1253/circj.CJ-20-1096.
- Viles-Gonzalez JF, de Castro Miranda R, Scanavacca M, Sosa E, d'Avila A. Acute and chronic effects of epicardial radiofrequency applications delivered on epicardial coronary arteries. Circ Arrhythm Electrophysiol. 2011 Aug;4(4):526-31. doi: 10.1161/CIRCEP.110.961508.
- Castaño A, Crawford T, Yamazaki M, Avula UM, Kalifa J. Coronary artery pathophysiology after radiofrequency catheter ablation: review and perspectives. Heart Rhythm. 2011 Dec;8(12):1975-80. doi: 10.1016/j.hrthm.2011.07.006.
- Hardy CA, Kulchetscki RM, Chokr MO, Pisani CF, Pinto Vandoni PM, Scanavacca MI. Right coronary artery occlusion after radiofrequency catheter ablation of a posteroseptal accessory pathway: Lessons to avoid it. HeartRhythm Case Rep. 2021 Nov 25;8(2):122-127.
doi: 10.1016/j.hrcr.2021.11.017.
- Стеклов В.И., Серговенцев А.А., Рзаев Ф.Г., Емельяненко М.В., Липская М.В., Валуев В.Е., Владимиров Ю.А. Радиочастотная катетерная аблация: биофизические основы и патофизиологические аспекты. Вестник аритмологии, 2018 (94): 47-65.
doi: 10.25760/VA-2018-94-47-65.
- Krause U, Abreu da Cunha FD, Backhoff D, Jacobshagen C, Klehs S, Schneider HE, et al. Effects of Triple Cryoenergy Application on Lesion Formation and Coronary Arteries in the Developing Myocardium. Pediatr Cardiol. 2017 Apr;38(4):663-668.
doi: 10.1007/s00246-016-1564-7.
- Austin KM, Alexander ME, Triedman JK. Pediatric T-wave memory after accessory pathway ablation in Wolff-Parkinson-White syndrome. Heart Rhythm. 2022 Mar;19(3):459-465. doi: 10.1016/j.hrthm.2021.11.007.
- P Soos M, C Madala M, Kanjwal K. Transient Inferior Lead ST Elevation During Radiofrequency Ablation of Atrial Fibrillation. J Atr Fibrillation. 2020 Apr 30;12(6):2293.
doi: 10.4022/jafib.2293.
- Mykytsey A, Kehoe R, Bharati S, et al. Right coronary artery occlusion during RF ablation of typical atrial flutter. J Cardiovasc Electrophysiol. 2010 Jul;21(7):818-21.
doi: 10.1111/j.1540-8167.2009.01711.x.

Рисунок 1. Внутрисердечная электрограмма в момент элиминации проведения по добавочному АВ-соединению
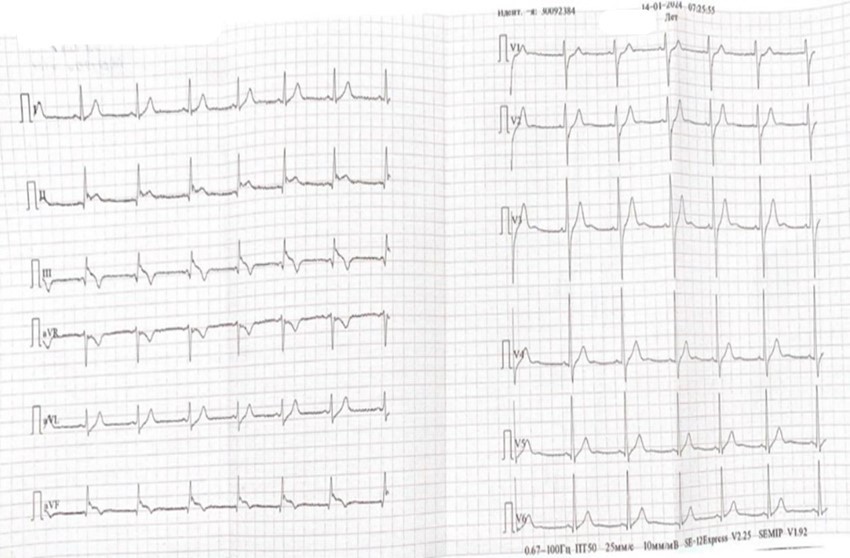
Рисунок 2. ЭКГ с подъёмом сегмента ST после РЧА добавочного АВ- соединения
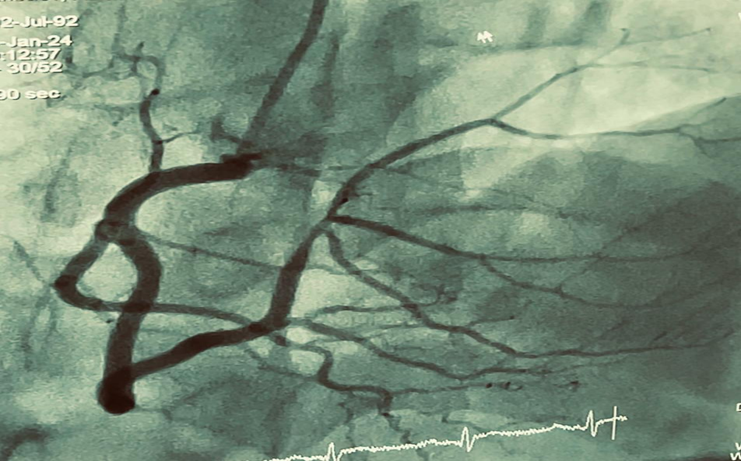
Рисунок 3. Стеноз 60-65 % в дистальной трети правой коронарной артерий
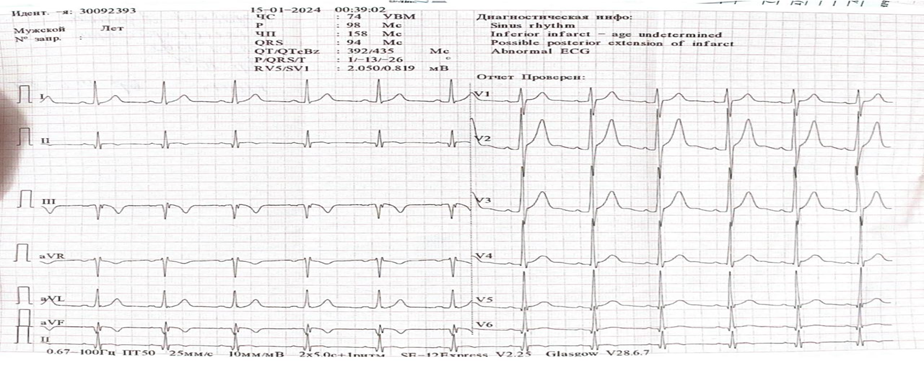
Рисунок 4. ЭКГ при выписке: динамика инфаркта миокарда нижней стенки левого желудочка с зубцом Q, подострый период
Дополнительные файлы